a. Baterai (sel Leclanche)
Baterai termasuk sel volta primer karena jika sumber
energinya habis tidak dapat diisi lagi. Baterai (elemen kering) sering disebut
sel Leclanche karena orang yang menemukan bernama Leclanche. Sel Leclanche
menggunakan batang karbon sebagai katode dan pelat seng sebagai anode.
Gambar 1. Potongan membujur baterai kering (sel Leclanche)
Di
dalamnya berisi pasta yang merupakan campuran batu kawi (MnO2),
amonium klorida (NH4Cl), karbon (C), dan sedikit air. Reaksi yang
terjadi pada baterai sebagai berikut.
Zn2+ yang terbentuk mengikat NH3
membentuk senyawa kompleks Zn(NH3)42+ dengan
reaksi sebagai berikut.
Zn2+(aq) + 4NH3(aq) → Zn(NH3)42+(aq)
Beda potensial satu sel kering adalah 1,5 volt dengan notasi
sebagai berikut.
Zn(s)│Zn2+(aq) || NH4+(aq) │
NH3(g) + H2(g) │ C(s) E° = 1,5 volt
b. Baterai alkalin
Akhir-akhir ini baterai alkalin banyak digunakan orang.
Mengapa? Hal ini tidak lain karena baterai alkalin mempunyai kekuatan arus
listrik yang lebih besar bila dibanding baterai biasa (sel Leclanche). Pada
dasarnya prinsip kerja baterai alkalin sama dengan sel kering, hanya saja
baterai alkalin menggunakan logam seng sebagai anode dan MnO2
sebagai katode serta elektrolit yang digunakan KOH.
Gambar 2. Baterai Alkaline
Reaksi yang terjadi pada baterai alkalin adalah sebagai
berikut.
Baterai ini lebih tahan lama dari sel kering biasa.
c. Baterai nikel-kadmium
Baterai nikel-kadmium adalah baterai kering yang dapat diisi kembali. Reaksi sel:
Perhatikan, sama seperti pada aki, hasil-hasil reaksi pada baterai nikel kadmium merupakan zat padat yang melekat pada kedua elektrodenya. Dengan membalik arah aliran elektron, zat-zat tersebut dapat diubah kembali seperti zat semula.
Gambar 3. Bagian Bateria Nikel Cadmium
d. Sel aki
Sel aki tergolong jenis sel volta sekunder, karena jika zat yang ada di dalam aki habis, maka dengan mengalirkan arus listrik ke dalam sel aki zat semula akan terbentuk kembali, sehingga sel aki dapat berfungsi lagi. Sel aki terdiri atas Pb (timbal) sebagai anode dan PbO2 (timbal dioksida) sebagai katode. Anode dan katode merupakan zat padat (lempeng) yang berpori, keduanya dicelupkan di dalam larutan asam sulfat. Aki tidak memerlukan jembatan garam karena hasil reaksinya tidak larut dalam sulfat. Kedua elektrode disekat dengan bahan fiberglas agar keduanya tidak saling bersentuhan. Setiap sel aki mempunyai potensial 2 volt. Jadi, aki 6 volt terdiri 3 sel, aki 12 volt terdiri 6 sel, dan sebagainya. Masing-masing sel dihubungkan secara seri.
Gambar 4. Sel aki (accumulator) merupakan contoh sel Volta sekunder
Reaksi pengosongan aki adalah sebagai berikut.
Anode dan katode berubah menjadi zat yang sama yaitu PbSO4.
PbSO4 yang terbentuk jika dibiarkan akan menutup kedua elektrode
yang berupa kristal putih. Jika permukaan kedua elektrode sudah tertutup
endapan PbSO4, maka tidak terdapat selisih potensial, dikatakan aki
sudah habis setrumnya. PbO2 di katode dan Pb di anode berubah
menjadi PbSO4. Untuk mengembalikan PbSO4 menjadi Pb dan
PbO2, aki harus dialiri arus listrik. Selama pengosongan aki, H2SO4
diikat dan dihasilkan air. Dengan demikian kadar H2SO4 berkurang
dan massa jenis larutan berkurang. Aki yang baru diisi mengandung larutan
dengan massa jenis 1,25–1,30 gram/ cm3. Jika massa jenis larutan turun sampai
1,20 gram/ cm3, aki harus diisi kembali.
Pengisian aki dilakukan dengan membalik arah aliran elektron
pada kedua elektrode. Pada pengosongan aki, anode (Pb) mengirim elektron pada
katode; sebaliknya pada pengisian aki elektrode Pb dihubungkan dengan kutub
negatif sumber-sumber arus. PbSO4 yang terdapat pada anode mengalami
reduksi, sedangkan PbSO4 yang terdapat pada katode mengalami
oksidasi membentuk PbO2. Reaksi pengisian aki adalah sebagai
berikut.
Pada reaksi di atas terbentuk 4 H+ + 2 SO42–
→ 2 H2SO4, hal
ini akan menambah kadar dan massa jenis larutan.
e. Sel bahan bakar
Sel hidrogen-oksigen termasuk jenis sel bahan bakar yang terus-menerus dapat berfungsi selama bahan-bahan secara tetap dialirkan ke dalamnya. Sel ini digunakan pada pesawat ruang angkasa. Sel hidrogen-oksigen terdiri atas anode dari lempeng nikel berpori yang dialiri gas hidrogen dan katode dari lempeng nikel oksida berpori yang dialiri gas oksigen. Elektrolitnya adalah larutan KOH pekat.
Cara kerja
sel ini adalah
1. Gas
hidrogen yang dialirkan pada pelat nikel berpori teroksidasi membentuk H2O.
2 H2 + 4 OH– → 4 H2O + 4 e–
2. Elektron
yang dibebaskan bergerak melalui kawat penghantar menuju elektrode nikel
oksida.
3. Pada
elektrode nikel oksida elektron mereduksi O2 menjadi OH–.
O2 + 2 H2O + 4 e–
→ 4 OH–
Reaksi yang
terjadi pada sel ini sebagai berikut.
Anode : 2 H2(g)
+ 4 OH–(aq) → 4 H2O(l) + 4 e–
Katode : O2(g)
+ 2 H2O(l) + 4 e– → 4 OH–(aq)
2 H2(g) + O2(g)
→ 2 H2O(l)
Biasanya
pada sel ini digunakan platina atau senyawa paladium sebagai katalis.
Sumber Rujukan:
Ari Harnanto, Ruminten. 2009. Kimia 3 : Untuk SMA/MA Kelas XII. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Iman Rahayu. 2009. Praktis Belajar Kimia 1 : Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional




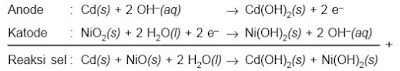







Tidak ada komentar:
Posting Komentar