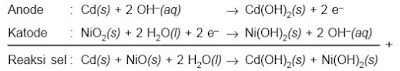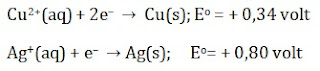Korosi dalam istilah sehari-hari kita kenal sebagai peristiwa perkaratan. Korosi ini sebenarnya merupakan peristiwa oksidasi logam oleh gas oksigen yang ada di udara membentuk oksidanya.
Proses korosi banyak menimbulkan masalah pada barang-barang yang terbuat dari besi walaupun logam-logam lain (kecuali logam mulia) dapat juga mengalami korosi.
Proses perkaratan pada besi dapat berlanjut terus sampai seluruh bagian dari besi hancur. Hal ini disebabkan oksida-oksida besi yang terbentuk pada peristiwa awal korosi akan menjadi katalis (otokatalis) pada peristiwa korosi selanjutnya. Hal itu berbeda dengan peristiwa korosi pada logam Al atau Zn.
Logam-logam ini tidak mulia bahkan mempunyai nilai E° lebih kecil dari besi berarti logam-logam ini lebih cepat teroksidasi. Namun oksida Al atau Zn yang terbentuk melekat pada logam bagian dalam dan bersifat melindungi logam dari proses korosi selanjutnya. Oleh sebab itu, logam Al atau Zn tidak akan hancur karena korosi seperti pada logam besi.
Barang-barang yang terbuat dari besi mudah mengalami korosi karena umumnya bukan terbuat dari besi murni melainkan campuran dengan unsur-unsur lain. Jika logam pencampurnya lebih mulia dari besi, maka besi akan menjadi anode yang akan habis teroksidasi secara terus-menerus, sebab paduan logam ini seolah-olah menjadi suatu sel volta yang mengalami hubungan pendek (korslet) oleh badan besi itu sendiri. Peristiwa ini akan lebih cepat terjadi jika barang berada di udara lembap atau terkena air, karena selain uap air, di udara juga terdapat gas-gas lain seperti CO2 atau SO2 yang dengan air akan membentuk larutan H2CO3 atau H2SO4 yang bersifat elektrolit.
Reaksi yang terjadi pada peristiwa korosi besi:
Pada reaksi ini jelas terlihat Fe akan lebih cepat teroksidasi dengan adanya molekul-molekul air yang dengan oksigen di udara berubah menjadi ion hidroksil. Ion Fe2+ yang terbentuk dapat mengikat molekul-molekul air membentuk hidrat atau berikatan dengan ion karbonat yang terbentuk dari CO2 dan uap air yang ada di udara.
1. Proses korosi
Proses korosi dapat dijelaskan sebagai berikut. Jika besi bersinggungan dengan oksigen atau bersinggungan dengan logam lain dalam lingkungan air akan terjadi sel elektrokimia di mana logam yang memiliki E°red lebih cepat sebagai anode dan E°red yang lebih besar sebagai katode. Logam atau unsur yang berfungsi sebagai anode, karena mengalami reaksi oksidasi, berarti yang mengalami korosi. Besi di udara akan berkarat, besi yang dilapisi seng, maka sengnya yang berkorosi sedangkan besi yang dilapisi timah putih, maka besinya yang mengalami korosi.
Gambar 1. Perkaratan besi
2. Pencegahan terhadap korosi
Berdasarkan proses terjadinya korosi, maka ada 2 cara yang dapat dilakukan untuk mencegah korosi, yaitu perlindungan mekanis dan perlindungan elektrokimia.
a. Perlindungan Mekanis
Perlindungan mekanis ialah mencegah agar permukaan logam tidak bersentuhan langsung dengan udara. Untuk jangka waktu yang pendek, cara ini dapat dilakukan dengan mengoleskan lemak pada permukaan logam.
Untuk jangka waktu yang agak lama, dapat dilakukan dengan pengecatan. Salah satu cat pelindung yang baik ialah meni (Pb3O4) karena selain melindungi secara mekanis juga memberi perlindungan elektrokimia. Selain pengecatan, perlindungan mekanis dapat pula dilakukan dengan logam lain, yaitu dengan cara penyepuhan.
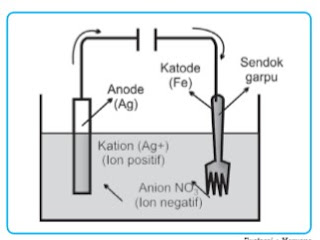
Gambar 2. Contoh proses penyepuhan
Proses penyepuhan untuk perlindungan terhadap korosi harus diperhatikan harga E° dari logam yang akan dilindungi dan logam pelindungnya. Logam yang baik sebagai pelindung harus mempunyai E° lebih kecil dari E° logam yang dilindungi. Sebab bila terjadi goresan pada logam yang dilapisi, maka logam pelindung akan menjadi anode pada “sel volta mini” yang terjadi, sehingga logam yang dilindungi tidak akan teroksidasi selama logam pelindung masih ada.
Untuk perlindungan agar barang-barang yang terbuat dari besi tidak cepat rusak, maka besi (E° = –0,44 volt) lebih baik dilapis dengan seng (E° = –0,76 volt) daripada dilapis dengan timah (E° = –0,14 volt).
Perlindungan mekanis dapat dilakukan dengan pengecatan
1) Besi yang dilapis seng
Apabila terjadi goresan atau lapisan mengelupas, kedua logam akan muncul di permukaan. Adanya uap air, gas CO2 di udara dan partikel-partikel lain, terjadilah sel volta mini dengan Zn sebagai anodenya dan Fe sebagai katodenya. Zn akan teroksidasi terlebih dahulu karena harga E°-nya lebih kecil daripada Fe, sehingga korosi elektrolitik (reaksi elektrokimia yang mengoksidasi logam) tidak terjadi.
2) Besi yang dilapis timah
Apabila terjadi goresan atau lapisan mengelupas kedua logam akan muncul di permukaan. Adanya uap air, gas CO2 di udara dan partikel-partikel lain terjadilah sel volta mini. Di sini Fe akan bertindak sebagai anode karena E° Fe lebih kecil daripada E°Sn, hingga Fe akan teroksidasi lebih dulu. Di sini akan terjadi proses korosi elektrolitik. Oleh karena itu, pelat besi yang dilapisi timah akan cepat berlubang-lubang daripada besi Galvani. Hanya dari segi keindahan, besi yang dilapisi dengan NiCr dan Sn tampak lebih bagus daripada besi yang dilapisi Zn.
b. Perlindungan elektrokimia
Perlindungan elektrokimia ialah mencegah terjadinya korosi elektrolitik (reaksi elektrokimia yang mengoksidasi logam).
Perlindungan elektrokimia ini disebut juga perlindungan katode (proteksi katodik) atau pengorbanan anode (anodaising). Cara ini dilakukan dengan menghubungkan logam pelindung, yaitu logam yang lebih tidak mulia (E°-nya lebih kecil). Logam pelindung ini ditanam di dalam tanah atau air dekat logam yang akan dilindungi. Di sini akan terbentuk “sel volta raksasa” dengan logam pelindung bertindak sebagai anode (lihat gambar).
Contoh-contoh proteksi katodik
1) Untuk mencegah korosi pada pipa di dalam tanah, di dekatnya ditanam logam yang lebih aktif, misalnya Mg, yang dihubungkan dengan kawat. Batang magnesium akan mengalami oksidasi dan Mg yang rusak dapat diganti dalam jangka waktu tertentu, sehingga pipa yang terbuat dari besi terlindung dari korosi.
Gambar 3. Proteksi katodik pada pipa air
2) Untuk melindungi menara-menara raksasa dari pengkaratan, maka bagian kaki menara dihubungkan dengan lempeng magnesium yang ditanam dalam tanah. Dengan demikian menara besi akan menjadi katode magnesium dan lempeng Mg sebagai anodenya.
Gambar 4. Menara Besar
Kegunaan Elektrolisis
Elektrolisis banyak digunakan dalam bidang industri, di antaranya pada pembuatan beberapa bahan kimia, pemurnian logam dan penyepuhan.
Pembuatan Beberapa Bahan Kimia Beberapa bahan kimia seperti logam alkali dan alkali tanah aluminium, gas hidrogen, gas oksigen, gas klorin, dan natrium hidroksida dibuat secara elektrolisis.
Contoh: Pembuatan logam natrium dengan mengelektrolisis lelehan NaCl yang dicampur dengan CaCl2
Natrium cair yang terbentuk dikatoda mengapung di atas cairan NaCl, kemudian dikumpulkan pada kolektor.