Banyaknya arus listrik yang dihasilkan dari kedua elektrode di atas dapat ditentukan besarnya dengan menetapkan potensial elektrode dari Zn dan Cu. Hanya saja potensial elektrode suatu zat tidak mungkin berdiri sendiri, harus ada patokan yang menjadi standar. Sebagai elektrode standar digunakan elektrode hidrogen. Elektrode ini terdiri atas gas hidrogen murni dengan tekanan 1 atm pada suhu 25 ºC yang dialirkan melalui sepotong platina yang tercelup dalam suatu larutan yang mengandung ion H+ sebesar 1 mol/ liter.
Potensial elektrode hidrogen standar diberi harga = 0 volt (Eº = 0 volt).
Tetapi jika zat ternyata lebih mudah melakukan reaksi oksidasi dibanding hidrogen, maka harga potensial elektrodenya adalah negatif. Dalam hal ini potensial oksidasinya positif, tetapi karena potensial elektrode harus ditulis reduksi berarti potensial reduksinya adalah negatif.
Jadi, potensial elektrode digambarkan dengan setengah reaksi reduksi.
PERHITUNGAN POTENSIAL SEL (E°)
Besarnya potensial sel dari suatu reaksi redoks dalam sel volta merupakan total dari potensial elektrode unsur-unsur sesuai dengan reaksinya. Dalam hal ini, hasil perhitungan potensial sel bisa positif atau bisa negatif. Jika potensial sel bertanda positif berarti reaksi dapat berlangsung, sedangkan jika potensial sel bertanda negatif berarti reaksi tidak dapat berlangsung.
CONTOH:
PERKIRAAN BERLANGSUNGNYA REAKSI
Memperkirakan berlangsungnya suatu reaksi sudah dijelaskan, yaitu dengan menentukan tanda potensial sel. Jika tanda potensial sel positif, maka reaksi berlangsung dan tanda potensial sel negatif, reaksi tidak berlangsung. Dalam perkiraan berikut ini tidak menggunakan perhitungan, tetapi hanya memperkirakan dari unsur-unsur yang terdapat dalam deret volta.
Reaksi ini berlangsung dengan syarat logam L terletak di sebelah kiri dari logam M. Reaksi ini disebut juga reaksi pendesakan dalam deret volta dengan pengertian logam L yang bebas (atomik) di sebelah kiri mendesak logam M yang terikat (bentuk ion/garam) di sebelah kanan. Logam L yang mendesak lebih aktif dibanding logam M yang didesak.
Contoh Penerapan:
Perhatikan contoh soal nomor 1 dan 2 di atas. Hasil perhitungan berharga Eo positif. Artinya reaksi dapat berlangsung.
Berikut ini penjelasan untuk Contoh soal Nomor 1.
Perhatikan bahwa potensial elektroda (Eo) yang nilainya positif cenderung mengalami reaksi reduksi, sedangkan potensial elektroda (Eo) yang nilainya negative cenderung mengalami reaksi reduksi. EoCu > Eo Zn, maka Cu mengalami reaksi reduksi, Zn mengalami reaksi oksidasi
Perhitungan Eosel dengan persamaan
Eosel = Eoreduksi − Eooksidasi
Eosel = 0,34V − (−0,76V)
Eosel = 0,34V + 0,76V = +1,10 V
Berikut ini contoh soal untuk nomor 2
Perhatikan bahwa potensial elektroda (Eo) yang nilainya positif cenderung mengalami reaksi reduksi, sedangkan potensial elektroda (Eo) yang nilainya negative cenderung mengalami reaksi reduksi. Cu dan Ag memiliki harga potensial elektroda (Eo) yang sama-sama bernilai positif, namun EoAg > EoCu, sehingga Ag mengalami reaksi reduksi, Cu mengalami reaksi oksidasi
Perhitungan Eosel dengan persamaan
Eosel = Eoreduksi − Eooksidasi
Eosel = 0,80V − 0,34V) = + 0,46 V (reaksi berlangsung)
Perhatikan logam bebas (atomik) mendesak logam terikat (bentuk ion/ garam). Dalam deret volta semua logam bebas berada di sebelah kiri logam terikat. Jika kelima contoh reaksi di atas dihitung potensial selnya, maka akan bertanda positif.
Perhatikan logam bebas (atomik) berada di sebelah kanan logam terikat (bentuk ion/garam) dalam deret volta. Berarti kelima reaksi di atas tidak berlangsung (tidak terjadi reaksi). Jika dihitung potensial sel, maka akan berharga negatif.
Contoh penerapannya.
Perhatikan harga Eo berikut
Berdasarkan persamaan reaksi tersebut, maka
dapat dicari harga Eo sel, Dari arah reaksi Ni mengalami reaksi
oksidasi, dan Zn mengalami reduksi. Mari kita terapkan ke rumus.
Eosel = Eoreduksi − Eooksidasi
Eosel = EoZn − EoNi
Eosel = −0,76V − (− 0,25V) (reaksi
berlangsung)
Eosel = −0,76V + 0,25V = −0,51 V (reaksi
tidak berlangsung)
Tugas
Perhatikan persamaan reaksi dan harga Eo dari reaksi pada nomor a, b, dan c.
Tentukanlah harga sel dari reaksi a, b, dan c, kemudian jelaskan apakah reaksi dapat berlangsung.
Catatan:
1. Tugas Dikerjakan berkelompok
2. Tiap kelompok terdiri dari 3 orang siswa
3. Formulir hanya dikerjakan sekali
SILAHKAN KIRIMKAN JAWABAN ANDA KE LINK DI BAWAH INI!

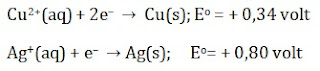
























Tidak ada komentar:
Posting Komentar