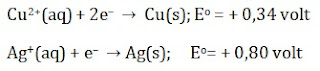Sel elektrokimia dibedakan atas:
a. Sel Volta/Sel Galvani
b. Sel elektrolisis
Persamaannya:
1. Pada sel elektrokimia, baik sel Volta maupun sel elektrolisis digunakan elektrode, yaitu katode, anode, dan larutan elektrolit.
2. Reaksi yang terjadi pada sel elektrokimia adalah reaksi redoks, pada katode terjadi reduksi, sedangkan pada anode terjadi oksidasi. Perbedaannya dapat Anda lihat pada tabel berikut.
Perbedaan Sel Volta dengan Sel Elektrolisis
Selidiki Kasus Berikut
Telah dipelajari sebelumnya bahwa logam-logam pada umumnya memiliki sifat energi ionisasi yang relatif rendah dan afinitas elektron yang relatif kecil. Oleh karena itu, unsur-unsur logam cenderung mengalami oksidasi (melepaskan elektron) dan bersifat reduktor.
Pada reaksi logam dengan asam, atom logam mengalami oksidasi dan ion hidrogen mengalami reduksi. Namun, tidak semua logam mampu bereaksi dengan asam, contohnya perak dan tembaga tidak mampu mereduksi ion hidrogen.
Reaksi redoks antara logam dan asam berlangsung spontan bergantung pada mudah atau sukarnya logam itu mengalami oksidasi (kuat atau lemahnya sifat reduktor). Alessandro Volta melakukan eksperimen dan berhasil menyusun deret keaktifan logam atau deret potensial logam yang dikenal dengan deret Volta.
Semakin ke kiri suatu unsur dalam deret Volta, sifat reduktornya semakin kuat. Artinya, suatu unsur akan mampu mereduksi ion-ion unsur di sebelah kanannya, tetapi tidak mampu mereduksi ion-ion dari unsur di sebelah kirinya. Logam Na, Mg, dan Al terletak di sebelah kiri H sehingga logam tersebut dapat mereduksi ion H+ untuk menghasilkan gas H2, sedangkan logam Cu dan Ag terletak di sebelah kanan H sehingga tidak dapat mereduksi ion H+ (tidak bereaksi dengan asam). Deret Volta juga dapat menjelaskan reaksi logam dengan logam lain. Misalnya, logam Zn dimasukkan ke dalam larutan CuSO4. Reaksi yang terjadi adalah Zn mereduksi Cu2+ (berasal dari CuSO4) dan menghasilkan endapan logam Cu karena Zn terletak di sebelah kiri Cu.
Contoh 1.
Manakah logam-logam berikut ini yang dapat bereaksi dengan larutan HCl untuk menghasilkan gas H2?
K, Ba, Zn, Su, Ag, Hg, Pt, Cr, Pb
Jawab:
Logam-logam yang tepat bereaksi dengan asam adalah logam yang terletak di sebelah kiri H dalam deret Volta yaitu K, Ba, Zn, Sn, Cr, dan Pb. Adapun logam-logam Ag, Hg, dan Pt terletak di sebelah kanan H sehingga tidak bereaksi dengan asam. Jadi, logam yang dapat bereaksi dengan HCl adalah K, Ba, Zn, Sn, Cr, dan Pb.
Contoh 2.

Sel Volta/Sel Galvani
Penemu sel ini ialah ahli kimia Italia Alessandro Volta dan Luigi Galvani. Sel ini merupakan salah satu sel elektrokimia pertama yang dikembangkan.Untuk lebih memahami sel Volta tontonlah video berikut!
Bandingkanlah
kesimpulan yang Anda peroleh dengan penjelasan berikut. Pada sel Volta
digunakan elektrode negatif (anode) dari batang zink (seng) yang dicelupkan
dalam larutan ZnSO4 dan elektrode positif (katode) dari batang
cuprum (tembaga) yang dicelupkan dalam larutan CuSO4. Kedua larutan
dihubungkan dengan jembatan garam atau dipisahkan oleh dinding berpori. Jembatan garam terdiri atas pipa berbentuk U yang berisi agaragar yang mengandung garam kalium klorida. Fungsi jembatan garam adalah untuk mempertahankan kenetralan medium elektrolit tempat batang elektrode berada.
Diagram sel:
Anoda ││ Katoda
Reaksi
Oksidasi ││ Reaksi Oksidasi
A │Am+ ││ Bn+
│B
Contoh 3.
Contoh 4.

Tugas
Soal 1.
Soal 2.
Catatan:
1. Tugas Dikerjakan berkelompok
2. Tiap kelompok terdiri dari 3 orang siswa
3. Formulir hanya dikerjakan sekali
Silahkan kirimkan jawaban Anda di Link Berikut!