B
|
anyak senyawa yang sering kita temui
misalnya air, gula, garam dapur, asam cuka, alkohol, dan urea. Apakah senyawa
itu? Senyawa merupakan gabungan unsur-unsur dengan perbandingan tetap. Rumus
yang menyatakan komposisi atom yang menyusun senyawa disebut rumus kimia. Rumus
kimia dapat berupa rumus empiris dan rumus molekul. Setiap rumus kimia
mempunyai nama dengan aturan-aturan yang telah ditentukan dan disebut tata nama
senyawa. Dengan mengetahui rumus kimia kita dapat menuliskan zat-zat yang
bereaksi dan hasil reaksinya dalam suatu persamaan reaksi. Berikut ini akan
dibahas rumus kimia yang terdiri dari rumus kimia senyawa kovalen dan rumus
kimia senyawa ion. Tata nama senyawa yang terdiri dari senyawa anorganik dan
senyawa organik. Akan dibahas juga persamaan reaksi dan bagaimana menyetarakan
persamaan reaksi.
Di alam
unsur-unsur ada yang stabil berdiri sendiri seperti gas mulia, ada juga yang
membentuk senyawa dengan unsur lain seperti hidrogen dan oksigen membentuk air.
Senyawa ada yang berbentuk senyawa kovalen dan ada juga yang berbentuk senyawa
ion.
Rumus
yang menyatakan komposisi atom-atom penyusun senyawa disebut rumus kimia. Rumus
kimia mengandung lambang-lambang unsur dan angka yang menunjukkan jumlah
unsur-unsur penyusun senyawa. Perhatikan penulisan rumus kimia berikut ini.
X dan Y menyatakan lambang unsur dan
angka 2 menunjukkan jumlah unsur X
Unsur-unsur
ada yang berdiri sendiri atau
monoatomik, ada juga yang terdiri dari dua atom yang sama (diatomik) dan lebih
dari dua atom yang sama (poliatomik).
Rumus kimia untuk unsur monoatomik ditulis sesuai dengan lambang
unsurnya.Rumus kimia untuk molekul diatomik dan poliatomik ditulis dengan
menuliskan lambang unsurnya ditambah angka yang menunjukkan jumlah atomnya.
Kadang-kadang perbandingan jumlah atom-atom pada rumus molekul
merupakan perbandingan paling sederhana maka rumus empiris senyawa akan sama
dengan rumus molekulnya misalnya H2O, H2SO4,
dan NH3.
Rumus empiris lebih banyak digunakan untuk menyatakan rumus
kimia senyawa-senyawa ion, misalnya natrium klorida dengan rumus kimia NaCl mempunyai
perbandingan ion Na+ dan Cl– = 1 : 1, asam sulfat dengan rumus H2SO4
mempunyai perbandingan ion H+ dan SO42– = 2 : 1.
Senyawa ion dibentuk oleh ion positif dan ion negatif. Senyawa
ion tidak bermuatan sebab jumlah muatan positifnya sama dengan jumlah muatan negatifnya.
Misalnya CaCl2 dibentuk dari 1 ion Ca2+ dan 2 ion Cl–, jumlah
muatannya adalah +2 + (-2) = 0. Rumus kimia beberapa senyawa ion tertera pada
Tabel 1.
Dalam kehidupan sehari-hari, banyak senyawa yang dikenal baik
karena kegunaannya maupun karena
dampaknya terhadap lingkungan, misalnya garam dapur yang memiliki rumus NaCl
dengan nama natrium klorida dan gas hasil pembakaran bahan bakar yang memiliki
rumus CO2 dengan nama karbon dioksida. Pemberian nama dari rumus-rumus tersebut
mengikuti aturan-aturan. Salah satu aturan pemberian nama senyawa yaitu aturan
IUPAC (International Union Pure and Applied Chemistry). Senyawa kimia
dikelompokkan dalam senyawa anorganik
dan organik.
Senyawa-senyawa anorganik pada umumnya merupakan senyawa ion,
terbentuk dari kation dan anion. Untuk memahami tata nama senyawa ion, kamu
harus mengenal dulu nama-nama kation dan anion. Perhatikan Tabel 2. dan Tabel
3.
Pemberian nama senyawa yang berikatan ion diawali dengan
menuliskan nama ion positif kemudian nama ion negatifnya, misalnya KI memiliki
nama kalium iodida karena berasal dari ion K+
dan ion I–. Pemberian nama senyawa ion yang biner dan
poliatom berbeda. Begitu juga nama senyawa hidrat, senyawa asam, dan senyawa
basa.
1)
Tata Nama Senyawa Biner
Senyawa biner tersusun dari 2 unsur. Yang
termasuk dalam senyawa biner adalah senyawa ion dan senyawa kovalen.
Pada senyawa ion yang termasuk biner, senyawa dibentuk dari ion logam (kation) dan nonlogam (anion). Pemberian nama senyawa biner dimulai dengan nama logam kemudian nama nonlogam dengan diberi akhiran –ida.
Video tata nama senyawa ion
2. Tata Nama Senyawa Poliatomik
Pada senyawa ion salah satu ion atau kedua ion dapat merupakan
ion poliatom. Ion poliatom biasanya terdiri dari dua unsur yang bergabung dan mempunyai
muatan, seperti CO32– dan SO42–.
Untuk anion sejenis tetapi jumlah oksigennya berbeda, aturan tata
namanya yaitu:
Tata Nama Senyawa Hidrat
Senyawa-senyawa tertentu ada yang dapat mengikat molekul air
(hidrat), misalnya MgSO4.7H2O. Pemberian nama senyawa
hidrat yaitu menyebutkan nama senyawa diikuti dengan jumlah hidrat yang ditulis
dengan sistematika nomor Romawi lalu kata hidrat.
MgSO4.7H2O
mengikat 7 hidrat (air) maka namanya yaitu magnesium
sulfatheptahidrat. Nama senyawa
hidrat untuk senyawa yang lain dapat dilihat pada Tabel 5.
Tata Nama Senyawa Asam dan Basa
Senyawa Asam
Senyawa asam akan dibahas pada bab larutan elektrolit tetapi
tata nama asam dapat dipelajari berikut ini. Asam merupakan senyawa yang
mengandung kation H+ dan suatu anion. Asam terdiri dari asam biner dan asam
poliatom atau asam oksi. Asam biner terdiri dari dua jenis atom.
Senyawa Basa
Senyawa basa dibentuk oleh ion logam sebagai kation dan ion OH–
atau ion hidroksida sebagai anion. Penamaan senyawa basa yaitu dengan menuliskan nama logam di
depan kata hidroksida.
Senyawa kovalen biner dibentuk dari dua unsur nonlogam,
contohnya amoniak NH3, metana CH4 , dan air H2O.
Nama senyawa tersebut adalah nama yang dikenal sehari-hari.
Tata nama senyawa kovalen yaitu dengan menuliskan jumlah unsur
pertama, nama unsur, jumlah unsur kedua, dan nama unsur kedua diikuti akhiran -ida.
Video Tata Nama Senyawa Kovalen
Tata nama senyawa organik lebih kompleks daripada tata nama
senyawa anorganik. Hal ini disebabkan sebagian besar senyawa organik tidak
dapat ditentukan dari rumus kimianya saja, akan tetapi harus dari rumus
strukturnya. Jumlah senyawa organik lebih banyak dibandingkan senyawa anorganik.
a.
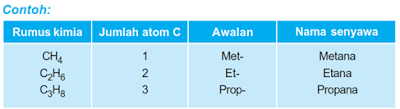
Senyawa organik paling sederhana
hanya mengandung atom C dan H. Nama senyawa dimulai dengan awalan sesuai jumlah
atom C dan diberi akhiran –ana.
b.
Senyawa organik penting lainnya ialah
benzen (C6H6). Penamaan senyawa jika atom H diganti
dengan atom/gugus lainnya yaitu sebagai berikut.
Senyawa organik yang termasuk senyawa hidrokarbon terdiri dari
alkana, alkena dan alkuna. Contoh dari senyawa hidrokarbon disajikan pada Tabel
7.
Beberapa nama senyawa
organik yang banyak digunakan sehari-hari dapat dilihat pada Tabel 8.





























Komentar ini telah dihapus oleh pengarang.
BalasHapusBagaimana nama HCLO4?
BalasHapusHClO4 adalah senyawa asam poliatomik.
HapusHClO4 ---> H+ + ClO4-.
Jadi penamaannya berdasarkan aturan senyawa poliatomik dengan cara menuliskan asam kemudian ion poliatomiknya
Jadi nama HClO4 = asam perklorat
bagaimana memberi nama CuCl2, 5H2O ?
BalasHapusCuCl2.5H2O adalah salah satu senyawa hidrat yg tersusun dr unsur Cu,Cl dan hidratnya. Cu adalah unsur transisi yg memiliki lbh dari satu bilangan oksidasi .Jd penamaannya dipengaruhi juga oleh biloksnya. Jika dilihat Dr jumlah atom Cl yg diikat maka bilangan oksidasi unsur Cu adalah +2.
HapusLangkah penamaannya adalah: tuliskan nama logam Cu kemudian bilangan oksidasi dlm bentuk huruf romawi yg ditulis dalam tanda kurung kemudian nama nonloga Cl diberi ahkiran ida dan jumlah air dan hidrat. Jumlah hidratnya = 5 --> penta
CuCl2.5H2O = tembaga (II) klorida penta hidrat